Prilezhaev反应,又称Prileschajew反应或Prilezhaev环氧化反应,为烯烃与过氧酸形成环氧化物的化学反应。该反应由尼古拉·普里列扎耶夫(Nikolai Prilezhaev)于1909年首次报告,并因此得名。该反应常用的过氧酸为间氯过氧苯甲酸(m-CPBA),因其性质相对稳定,且在大多数有机溶剂中有较好的溶解度。如下所示的反应实例中,mCBPA使反-2-丁烯环氧化,得到反-2,3-环氧丁烷:

该反应有高度立体专一性,C=C双键的立体异构通常可以完全保真地在环氧化物中得以保持。所以反式烯烃仅会形成反式环氧化物(如上例所示),而顺式烯烃只会产生顺式环氧化物。这种立体专一性是协同反应机理的结果,具体如下所述。
目前普遍承认的Prilezhaev反应机理为Paul Bartlett首先提出的“蝴蝶机理”。在该机理中,过氧酸在反应过渡态中形成分子内氢键。尽管在两个方向上都存在前线轨道轨道相互作用,但过氧酸通常被视为亲电体,而烯烃则被视为亲核体。可以印证这一规律的是,C=C双键上的电子云密度越大,环氧化反应的速率通常越快。例如,随着烯烃上取代的甲基数量增加,环氧化反应的相对速率变化如下:乙烯(1,无甲基)<丙烯(24,一个甲基)<顺-2-丁烯(500,两个甲基)<2-甲基-2-丁烯(6500,三个甲基)<2,3-二甲基-2-丁烯(>6500,四个甲基)。甲基的超共轭效应增加了双键的电子密度,导致了环氧化反应的速率变化。
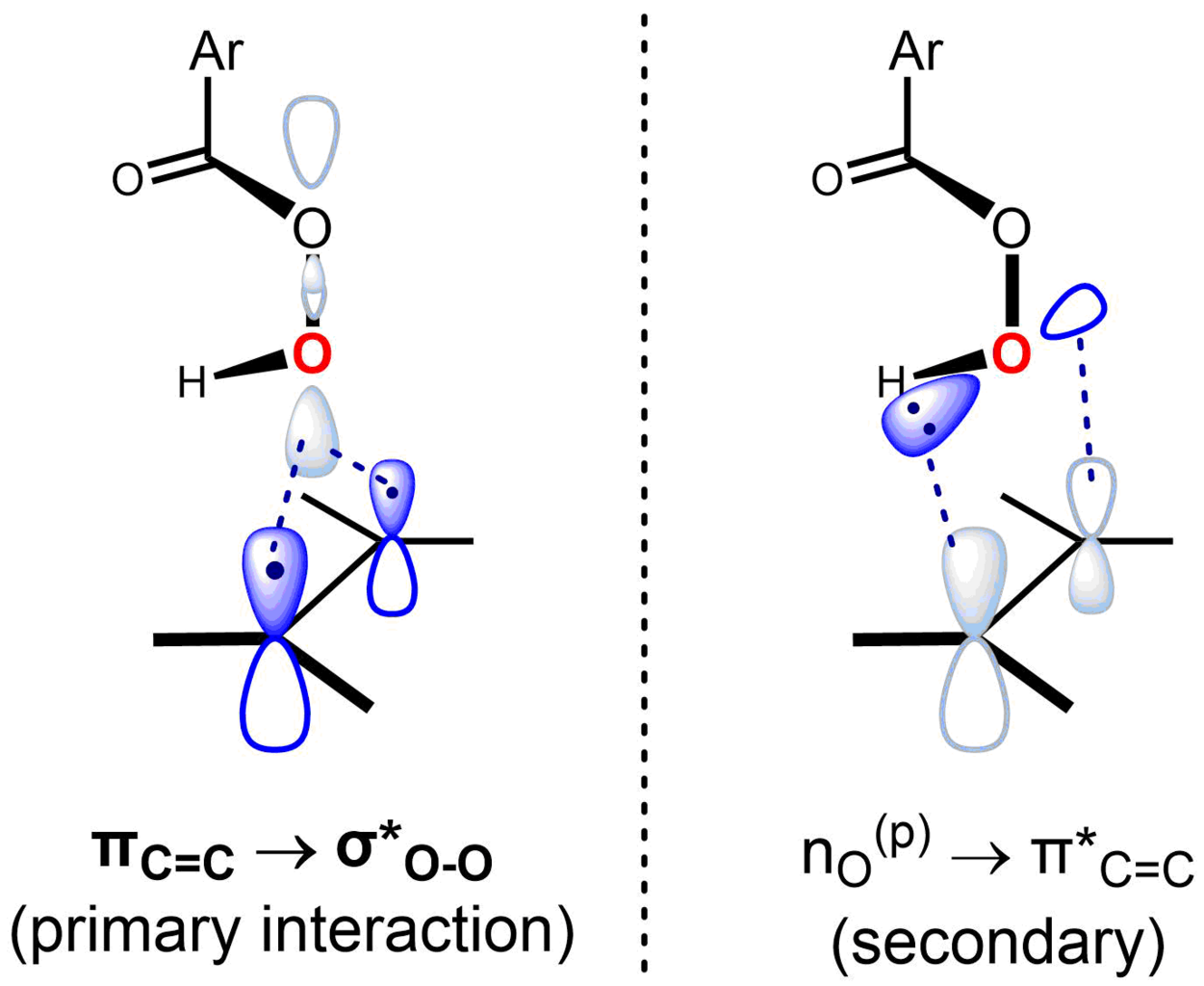
Prilezhaev反应属协同反应机理,具有同步(或近同步)的过渡态。在“蝴蝶机理”的过渡态构型中,过氧酸所在平面将烯烃所在平面一分为二,过氧O-O键垂直于烯烃双键。这种构象使关键的前线轨道相互作用得以进行。其中主导性的相互作用为占据的πC=C轨道(HOMO)和未占的σ*O-O轨道(LUMO)间的相互作用,该相互作用可解释反应中烯烃的亲核性与过氧酸的亲电性。反应的次要相互作用为垂直于过氧酸平面的孤对电子轨道nO(p)(HOMO)与未占据的π*C=C轨道(LUMO)之间的相互作用。根据Anslyn & Dougherty,环氧化反应的机理可以表示如下:

文章来自网络




