DMSO和不同亲电试剂的组合可组成一类应用广泛的氧化剂体系。其中,Moffatt所发展的,在酸催化下,醇用DMSO-DCC体系氧化成醛、酮,称为Moffatt氧化。常用的酸为强酸的吡啶盐,如磷酸或三氟乙酸吡啶和磷酸、二氯乙酸。DMSO不一定用作溶剂,如加入乙酸乙酯作为共溶剂效果更佳。反应机理基于DMSO氧化反应的机理均涉及亲电试剂对DMSO的活化,使硫原子成为亲电中心,可经受醇的进[阅读全文]
博文
(2022-08-25 17:52:34)
DMSO和不同亲电试剂的组合可组成一类应用广泛的氧化剂体系。其中,Moffatt所发展的,在酸催化下,醇用DMSO-DCC体系氧化成醛、酮,称为Moffatt氧化。常用的酸为强酸的吡啶盐,如磷酸或三氟乙酸吡啶和磷酸、二氯乙酸。DMSO不一定用作溶剂,如加入乙酸乙酯作为共溶剂效果更佳。反应机理基于DMSO氧化反应的机理均涉及亲电试剂对DMSO的活化,使硫原子成为亲电中心,可经受醇的进[阅读全文]
(2022-08-25 17:24:41)
(2022-08-23 18:17:00)
(2022-08-23 18:01:39)
(2022-08-23 17:39:41)
(2022-08-20 15:31:32)
无水氟化试剂可以通过SNAr氟化交换掉芳环的卤素,这在很多文献上已经有报道。OPRD在2021年4月份的最新报道中提到,通过小试筛选,他们发现无水的四甲基氟化铵(TMAF,anh)可以通过氟氯交换成功实现噻唑环的氟化。但是市场上可商业获得的TMAF都是四水合物(TMAF-4H2O),很难买到无水的TMAF,而且作者期望他们的工艺是能用于放大生产的,因此能够稳定可靠的获得这种无水TMAF试剂[阅读全文]
(2022-08-20 14:18:52)
首先;千万不要麻痹!不要认为这个有机物料毒性小就可以疏忽大意,因为有的毒物是可以日积月累的!如果你要长期从事这项工作最好尽量减少同它们接触的机会,所以在实验室中要注意的有如下几点;1,环境很重要,实验室中尽量不要放太多的药品,特别是挥发性强的物料,无特殊要求每次实验尽量少投料。实验室每天都要打扫,对洒落的化学药品更要及时清理。2,实验[阅读全文]
(2022-08-16 19:18:37)
【英文名称】SodiumCyanoborohydride【分子量】62.85【CAS登录号】[25895-60-7]【结构式】NaBH3CN【物理性质】mp240~242oC(分解)。溶于大部分极性有机溶剂和水。常在甲醇、乙醇、四氢呋喃、水和乙酸中使用。【制备和商品】该试剂为白色固体,一般不在实验室制备。国内外化学试剂公司均有销售,特别是在不同溶剂中配成不同浓度的溶液商品试剂为使用带来了许多方便。【注意事项】该试[阅读全文]
(2022-08-16 19:08:03)
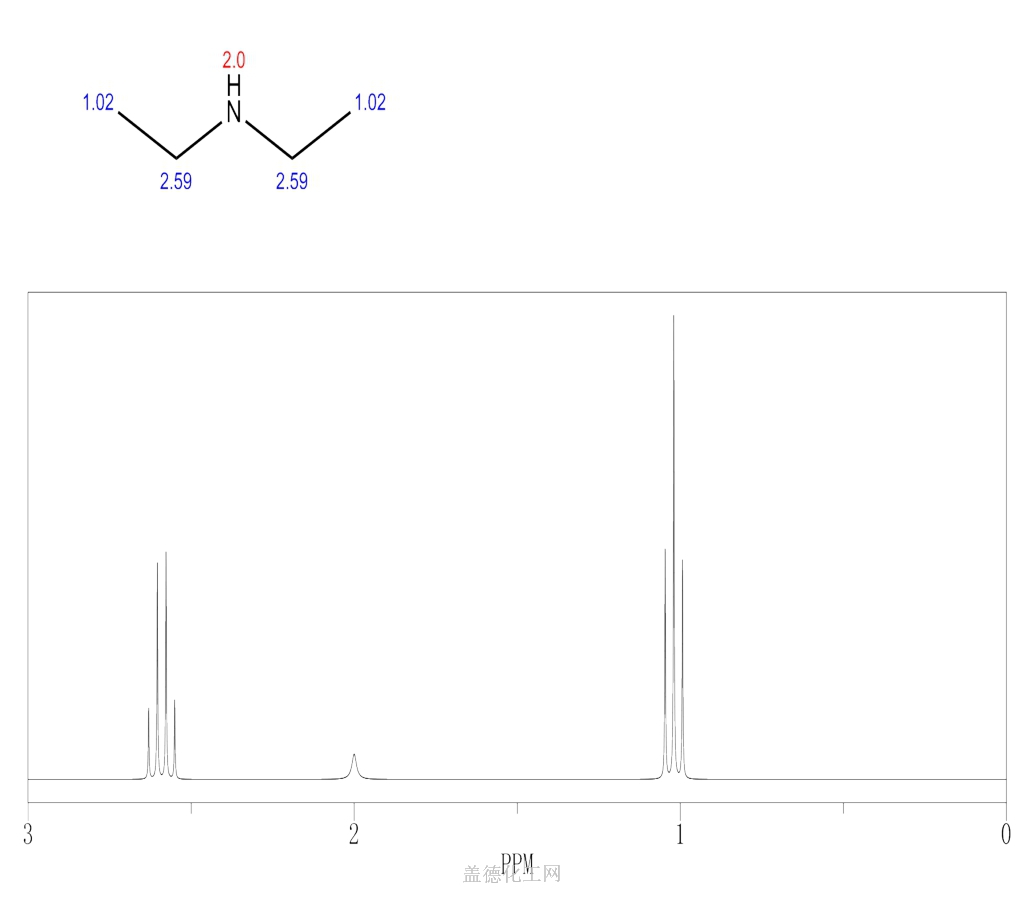
偶合常数的定义在一个自旋体系内,核磁共振的谱线发生了分裂;由分裂所产生的裂距反映了核的相互偶合作用的强弱,称为偶合常数,用J表示。通常情况下,通过单数键的偶合常数为正值(如1J、3J),通过双数键的偶合常数为负值(如2J)。“同碳”偶合常数(J同或2J)定义:2J表示跨越两根化学键的耦合常数。在这里主要讨论氢氢之间的2J,其对应的耦合也称为同碳耦[阅读全文]
(2022-08-16 18:31:07)
氢谱影响化学位移值的因素:只有空间效应和共轭效应是屏蔽效应增大,向高场位移,即σ↑,δ↓.1、0.4~4.0为饱和C上的H①0.4~1.8连饱和C的饱和C上的H②1.8~2.5连不饱和C的饱和C上的HI.1.8~2.1连C=C、C≡C的饱和C上的HII.2.1~2.5连C=O、N、S、苯环的饱和C上的H③3.0~4.6连-O-的饱和C上的H其中,4.1左右可能有酯基④例外的:2.3~3.0是叁键上的H2、4.6~8.0为不饱和C上的H①[阅读全文]