我行我素
清清白白做人,平平淡淡生活。
正文
《癌症发现》:超过正常数量1000倍的细菌驻扎胰腺癌组织,帮癌细胞策反巨噬细胞,抑制免疫系统,加速肿瘤发展 | 科学大发现(ZT)
奇点网
2018-03-30
2018-03-30
“内事不决问张昭,外事不决问周瑜。”胰腺癌也有这样的左膀右臂。
2017年9月,来自魏兹曼研究所的Ravid Straussman团队联合哈佛大学、麻省理工学院、剑桥大学等机构的研究者共同发现,一直以来被认为是无菌的胰腺癌组织内,不仅存在细菌,而且这些细菌居然助纣为虐地帮助癌组织“吃掉”常用抗癌化疗药物吉西他滨。只要特定微生物是癌细胞的座上宾,使用10倍于常用浓度的吉西他滨,也伤不得癌细胞分毫。Straussman教授团队的这一重要发现刊登在顶级期刊《科学》杂志上[1]。
如果说Straussman教授发现的细菌,是帮助胰腺癌抵抗抗癌药物打击的“周郎”;那么纽约大学的Deepak Saxena和George Miller团队发现的细菌,则是帮助胰腺癌镇压内部叛乱保持肿瘤稳定的“张昭”。
就在上周,Saxena和Miller团队再次证实胰腺组里是有细菌的,即使健康人的胰腺也不是处于无菌状态。但是,他们还发现,肠道微生物可以通过胰腺导管进入胰腺,这也导致胰腺癌患者胰腺里面的细菌数量,是健康人的近1000倍。更糟糕的是,这些细菌会教唆巨噬细胞,使其变成抑制免疫系统的坏蛋,让免疫细胞不能被激活,对癌组织视而不见[2]。
研究人员发现,如果单独使用抗生素消灭这些细菌,就可以恢复T细胞的杀伤力,直接使肿瘤缩小50%;如果使用抗生素之后,再用PD-1抗体,抗癌效果直接翻3倍[2]。Saxena和Miller的这项研究成果刊登在顶级医学期刊《癌症发现》(Cancer Discovery)上。

Cancer Discovery的论文首页真是别具一格啊~
近年来大量研究证实,肠道微生物与包括喉癌、食管癌、胃癌、结直肠癌和原发性肝癌等多种消化道恶性肿瘤的发生于发展有关[2],这主要是因为肠道微生物有机会直接与这些组织器官接触。
那胰腺癌的发生和发展会受到肠道微生物的影响么?
之前已经有研究表明,胰腺组织内固有免疫细胞表面识别微生物的模式识别受体(PRRs)被激活,会加速胰腺肿瘤的形成;而那些没有模式识别受体基因的小鼠,胰腺肿瘤的形成速度会放缓[3,4]。如此看来,胰腺里面可能有促进胰腺癌发展的微生物。
不过,为了严谨起见,研究人员决定还是先确认下肠道微生物是否真的能进入胰腺。于是他们强行给小鼠喂食了几种有荧光标记的肠道微生物,最后发现,这些微生物确实可以沿着胰腺分泌物的通道逆流而上,进入胰腺。
此外,研究人员还发现,胰腺癌患者胰腺组织里的细菌数量,与健康人胰腺组织细菌的数量差距特别巨大,前者是后者的1000倍左右。在分析12名胰腺癌患者胰腺组织之后,研究人员发现了13个门类的细菌,它们主要分布在Proteobacteria(45%)、Bacteroidetes(31%)和Firmicutes(22%)三个门类,Actinobacteria(1%)门类的丰度虽然低,但是几乎所有的胰腺癌患者胰腺里都有分布。
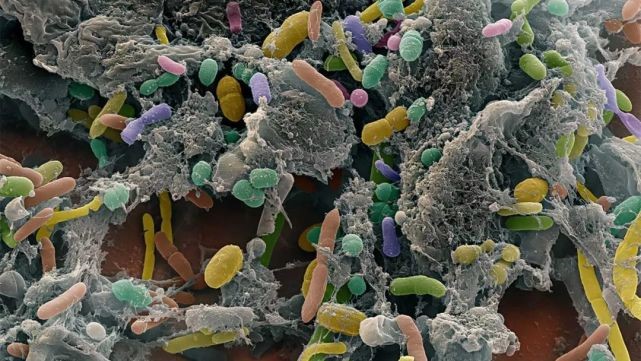
它们真的与胰腺癌的进展有关么?
还真是!
与对照组的有肠道细菌胰腺癌模式小鼠相比,肠道没有细菌的胰腺癌模式小鼠肿瘤进展缓慢,甚至可以说是,简直就不发展了。看来没有“张昭”,胰腺癌的壮大事业是发展不起来了。
如果给小鼠喂点儿抗生素,与没吃到抗生素的小鼠相比,它们的胰腺肿瘤负担直接减少50%,这可不是就算打掉了胰腺癌一半的势气么。
如此看来,肠道里面某些微生物确实为胰腺癌扮演着张昭的角色。
接下来,研究人员就需要找找,究竟有那些肠道微生物扮演了张昭的角色。通过长达36周的连续分析,他们最后发现双歧杆菌属里的Bifidobacterium pseudolongum(假长双歧杆菌)随着疾病的进展,丰度不断提高,最后成为最主要的细菌。后来他们也通过实验证实,假长双歧杆菌确实有促进胰腺癌发展的本事。

那假长双歧杆菌等促癌细菌究竟是如何调节肿瘤微环境,保护胰腺癌组织的呢?
这个问题好办,我们先用抗生素把肠道微生物都清除,看看胰腺癌模式小鼠的胰腺里面会发生什么变化。
结果,研究人员发现,具有抗癌活性的T细胞增多了,抑制免疫反应的骨髓源抑制细胞减少(MDSC,这家伙我们之前专门写过一篇文章介绍过);再来看看在肿瘤中大量存在的肿瘤相关巨噬细胞(TAM,这货我们之前也介绍过),抑制免疫反应的M2型TAM变少,负责激活免疫系统的M1型TAM变多。
同时,他们还发现如果用胰腺癌小鼠肠道微生物的无细胞提取液处理免疫细胞,可以抑制免疫细胞的活性,同时促进肿瘤生长的相关因子表达上调。有趣的是,假长双歧杆菌的无细胞提取液也有同样的效果。
如此看来,假长双歧杆菌等促癌细菌耍了一些手段,通过抑制免疫系统活性,打造了一个有利于癌组织的微环境。

George Miller(左)和Deepak Saxena(右)
在胰腺癌中,肠道细菌咋关闭的免疫系统呢?
这时不得不提到前文的模式识别受体了,这个受体存在于免疫细胞表面,为的就是识别病原菌。而与野生型小鼠相比,胰腺癌小鼠的细菌激活了不同的模式识别受体,进一步分析显示,胰腺癌中巨噬细胞的模式识别受体TLR通路被激活,促使巨噬细胞往抑制免疫系统的类型分化,进而抑制T细胞发动免疫应答的性能,加速肿瘤的形成。
此外,研究人员在实验过程中惊喜地发现,用抗生素减少胰腺癌患者肠道细菌可使肿瘤内T细胞的PD-1表达上调,如若此时再结合PD-1抗体治疗,可以增强肿瘤内T细胞的活性,将PD-1抗体抗癌效果提高3倍。
这对于胰腺癌患者来说无疑是个好消息。
目前,研究人员正计划在Perlmutter癌症研究中心招募胰腺癌患者,开展抗生素(环丙沙星和甲硝唑)联合PD-1抗体治疗的临床研究[5]。
期待他们带来好消息。
参考资料:
[1]. Geller L T, Barzily-Rokni M, Danino T, et al.
Potential role of intratumor bacteria in mediating tumor resistance to the chemotherapeutic drug gemcitabine[J]. Science, 2017, 357(6356): 1156-1160.
Potential role of intratumor bacteria in mediating tumor resistance to the chemotherapeutic drug gemcitabine[J]. Science, 2017, 357(6356): 1156-1160.
[2]. Pushalkar S, Hundeyin M, Daley D, et al. The Pancreatic Cancer Microbiome Promotes Oncogenesis by Induction of Innate and Adaptive Immune Suppression[J]. Cancer discovery, 2018.
[3]. Ibrahim J, Nguyen A H, Rehman A, et al. Dendritic cell populations with different concentrations of lipid regulate tolerance and immunity in mouse and human liver[J]. Gastroenterology, 2012, 143(4): 1061-1072.
[4]. Seifert L, Werba G, Tiwari S, et al. The necrosome promotes pancreatic oncogenesis via CXCL1 and Mincle-induced immune suppression[J].
Nature, 2016, 532(7598): 245.
Nature, 2016, 532(7598): 245.
[5].http://www.nyu.edu/about/news-publications/news/2018/march/gut-bacteria-determine-speed-of-tumor-growth-in-pancreatic-cance.html





谢谢来访。坦白地说,我不知道。按照一般推理来看,益生菌只是帮助肠道正常消化,没有杀菌的作用。
谢谢来访。这个报道了最新的研究动向,三月下旬发表在Cancer discovery。看来癌症治疗的思路不仅仅限制在传统途径,医学界正在进一步深入到各个方面。
胰腺癌号称癌症之王,发病率日渐提高,五年生存率极低,广泛受到重视。各种研究和方法都在开展,希望能早日找到治疗的有效途径。
谢白水兄,我在转载前也看到了,经兄提醒后,查阅了原文,原文中用的是phyla,应该译为“门类”,改了。
再一次谢谢!