去伪存真
探索自然之谜、辨别科学真伪、促进交流沟通、还原自然真知严重急性呼吸综合症(SARS,萨斯)在中国重复爆发的因素分析
刘实
在过去的17年中,在中国发生了两次广泛流行的严重急性呼吸综合征(萨斯),即萨斯1和萨斯2。它们均是由相关的冠状病毒引起:萨斯冠状病毒和萨斯冠状病毒-2。这些病毒的来源至今未知、其在自然界的发生也很神秘,但它们在发病机理和流行病学上还是有一些明显的共同端貌。
【
原文“Potential Factors Influencing Repeated SARS Outbreaks in China”于2020年3月3日发表于International Journal of Environmental Research and Public Health(国际环境研究与公共健康杂志)。 参见:
Abstract: https://www.mdpi.com/1660-4601/17/5/1633
HTML Version: https://www.mdpi.com/1660-4601/17/5/1633/htm
PDF Version: https://www.mdpi.com/1660-4601/17/5/1633/pdf
】
原文作者:
孙众1,Karuppiah Thilakavathy1,2,S.Suresh Kumar 2,3,何国忠4,* 刘实5,*
1马来西亚博特拉大学医学与健康科学学院生物医学科学系,马来西亚雪莱莪 43400;
2马来西亚博特拉大学医学与健康科学学院遗传与再生医学研究小组,马来西亚雪兰莪43400;
3马来西亚博特拉大学医学微生物学和寄生虫学系,马来西亚雪兰莪43400;
4昆明医科大学卫生研究所,昆明650500;
5 雄鹰分子医学研究所,Apex,美国北卡罗莱纳州27502;
*通讯:guozhong_he@vip.sina.com;SVL8EPA@gmail.com(S.V.L.);电话:+ 86-1360-885-6345(F.L.)
【翻译说明:
为了使不懂英文的读者能流畅地阅读本文的中文版,本文翻译将尽量避免使用英文词汇。故将一些比较关键的英文词汇集中于此,便于随时比对。
angiotensin-converting enzyme 2 (ACE2): 血管紧张素转换酶2
bat:蝙蝠
bat-SL-CoV:蝙蝠萨斯样冠状病毒
bamboo rat: 竹鼠
civet: 果子狸
coronaviruses (CoVs): 冠状病毒
COVID-19: 冠状病毒疾病-19
human coronaviruses(HCoV):人类冠状病毒
Middle East Respiratory Syndrome(MERS):中东呼吸综合征(塻斯)
horseshoe bat: 马蹄蝠
MERS-CoV: 中东呼吸综合征冠状病毒,塻斯冠状病毒
new coronavirus pneumonia (NCP): 新冠状病毒肺炎(新冠肺炎)
pangoline: 穿山甲
severe acute respiratory syndrome (SARS): 严重急性呼吸综合症(萨斯)
SARS-1: 萨斯1 (非典型肺炎;非典)
SARS-2: 萨斯2 (武汉肺炎;武肺;新冠病毒肺炎;新冠肺炎;冠状病毒疾病-19)
SARS-CoV: 萨斯冠状病毒
SARS-CoV-2: 萨斯冠状病毒-2
SARS-like COVs (SL-CoVs):萨斯样冠状病毒
Wuhan pneumonia: 武汉肺炎
2019-nCoV: 2019新冠病毒
】
摘要:在过去的17年中,在中国发生了两次广泛流行的严重急性呼吸综合征(萨斯),它们均是由相关的冠状病毒引起:萨斯冠状病毒和萨斯冠状病毒-2。这些病毒的来源至今未知、其在自然界的发生也很神秘,但它们在发病机理和流行病学上还是有一些明显的共同端貌。两种病毒都利用相同的受体-血管紧张素转换酶2-入侵人体。两种流行病均发生在有重大节庆假日的寒冷干燥冬季,并始于喜欢消费野生生物的地区。因此,如果蝙蝠是萨斯冠状病毒的天然宿主,那么低温和低湿度的这段时间可能为这些蝙蝠聚集地区内的病毒存活提供有利的环境条件。同时,寒冷的冬季使人体变得更加脆弱,使得广泛存在的蝙蝠携带或释放的病毒更容易突破人类的防御系统。一旦成功感染了一些最初的人群,随着社交聚会和节假日旅行的增加,疾病的传播变得更加迅速。这些自然和社会因素影响了萨斯流行病学的总体发展和轨迹。但是,一些独特的因素也可能导致萨斯在武汉的起源。本文在不同的场景中讨论了这些因素,以便促进更多的研究来实现最终验证。
关键词:武汉肺炎;冠状病毒;严重急性呼吸综合症(SARS,萨斯); 非典; COVID-19; 血管紧张素转换酶2;萨斯冠状病毒;2019-nCoV;暴发;疫情;流行病学;感染;干旱;蝙蝠;绿灯;红灯;野生动物;宿主;暴露;风险。
1.导言
自2002年以来,中国发生了两次严重急性呼吸综合征(萨斯)的流行,一次在2002年末,另一次在2019年末。这两次流行病的病原体已被确认为冠状病毒的新成员,分别是萨斯冠状病毒和萨斯冠状病毒-2(图1)[1]。冠状病毒由于其表面有冠状尖峰而被命名,分为四个属即alpha,beta,gamma和delta。在萨斯冠状病毒出现之前,已经有四种冠状病毒能够感染人类,即人类冠状病毒。这四种可以引起“普通感冒”的人类冠状病毒包括:alpha组的HCoV-229E和HCoV-NL63以及beta组的HCoV-OC43和HCoV-HKU1 [2]。此外,除了2002年在中国导致萨斯的萨斯冠状病毒[2]之外,2012年又发现了另一种引起中东呼吸综合征(塻斯)的冠状病毒:塻斯冠状病毒[3]。
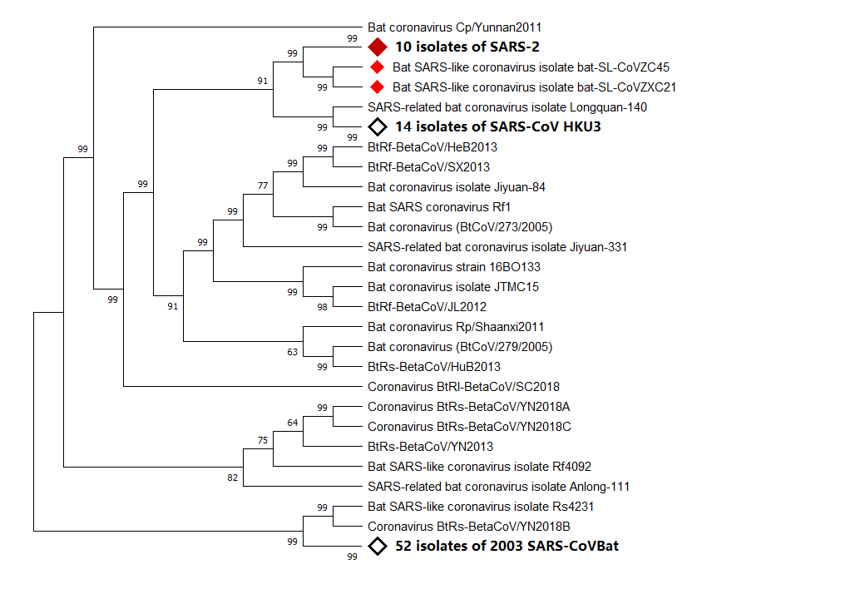
图1.应用从萨斯2病人体内分离出的病毒构建系统分类树。
使用BLAST工具,将萨斯2病人体内分离出的病毒株(武汉海鲜市场肺炎病毒分离株Wuhan-Hu-1)的序列与国家生物技术信息中心(NCBI)的全基因组序列数据库进行比对。 下载前100个匹配序列并使用MAFF(AIST)对齐后,使用MEGA X构建系统分类树。根据系统分类树,萨斯冠状病毒-2与蝙蝠萨斯样冠状病毒ZC45、 ZXC21具有共同的祖先。
与萨斯冠状病毒使用血管紧张素转化酶2(ACE2)作为与人类细胞结合的受体不同[4],塻斯冠状病毒使用二肽基肽酶4(DPP4)作为感染人类细胞的受体[5]。并且,从系统分类上来讲,塻斯冠状病毒和萨斯冠状病毒亦是截然不同的,也与包括人类冠状病毒在内的其他冠状病毒的相距甚远。
2019年底,在中国中部爆发的“武汉肺炎”与一种被命名为萨斯冠状病毒-2的新型冠状病毒有关。萨斯冠状病毒-2不仅与萨斯冠状病毒在系统分类上密切相关,而且还使用与萨斯冠状病毒相同的受体血管紧张素转换酶2。因此,尽管“武汉肺炎”曾被冠以“新冠状病毒性肺炎(NCP)”等多种其他疾病名称、现在更名为“冠状病毒病-19(COVID-19)”。但是,我们认为将“武汉肺炎”称为“萨斯2”,将先前的“萨斯”称为“ 萨斯1”更为合适。“武汉肺炎”的病原体名称已从“2019-新冠病毒”更改为“萨斯冠状病毒-2”。因此,将“冠状病毒病-19”进一步更改为“萨斯2”对于明确病原体和疾病之间的关系是合乎逻辑和理性的。在本文中,我们希望通过对影响2002年和2019年萨斯爆发的自然因素和社会因素的分析,了解该类疾病的一些共同流行病学特征。对这些特征的了解有利于预防和控制此类流行病的发生和发展。同时,也有助于搜索病毒的来源和阐明其最初的出现。
2. 萨斯1和萨斯2的共同流行病学特征
令人疑惑的是,在不到17年的时间里,中国爆发了两次类似的流行病:2002年的萨斯1和2019年的萨斯2。尽管研究病毒的起源对于了解这些流行病至关重要,但是,比较影响这两种流行病进展的自然因素和社会因素的也很重要。
通过对这两个严重公共卫生事件中的环境因素和人为因素进行比较分析,我们希望找到影响萨斯1和萨斯2发生的一些共同因素。
2.1.环境因素
萨斯1于2002年11月在广东省佛山市爆发[6]。萨斯2于2019年12月上旬在湖北省武汉市开始蔓延[7]。在中国,11月和12月是冬季,是这两个地区一年中最冷的月份[8,9]。低温通常为病毒的生存提供了有利的环境条件。除此之外,我们还注意到在疫情爆发时两个地区都发生了严重的干旱。佛山2002年12月的年降水量接近0毫米 [10]。事实上,当年广东省全境都发生了干旱,导致1300多个水库枯竭,28.6万公顷的农田遭受干旱[11]。巧合的是,2019年的武汉也遭受了近40年来最严重的干旱,2019年12月的降水量仅为5.5毫米[12,13]。这些干旱条件在这两个地方都是罕见的,因为它们的年平均降水量大于1100毫米[8,9],高于全球990毫米的年平均降雨量,其中陆地上的平均降雨量为715毫米[14]。寒冷,干燥的联合因素比单纯寒冷更有利于病毒存活[15,16]。在寒冷干燥的冬季,风干的病毒颗粒是一种危险的病毒形式,可以在空气气流中存活很长一段时间[17]。
除了为病毒的生存和传播提供有利条件外,冬季的干冷条件也会削弱人类的先天免疫力。低温会导致鼻腔粘膜的血液供应减少,从而导致免疫细胞向鼻粘膜的供应减少。同时,低湿度会降低气道中纤毛细胞清除病毒颗粒,分泌粘液以及修复气道细胞的能力。此外,通常人类细胞在病毒感染后会释放信号蛋白,以提醒邻近细胞注意病毒入侵的危险。然而,在低湿度环境中,这种先天免疫防御系统也会受到损伤[18]。更严重的是,低湿度会导致鼻粘液变干;鼻腔内壁变得脆弱,甚至破裂;并使整个上呼吸道更易受病毒入侵[19]。
而另一种冠状病毒爆发的环境状况似乎也支持上述理论。2012年6月,在沙特阿拉伯吉达居住的一人是首例感染塻斯冠状病毒的病人 [20]。吉达的年降雨量仅有61毫米,而当年6月该地甚至于无降雨[21]。因此,相对于温度,低湿度似乎是影响人类冠状病毒疾病爆发的更关键的环境因素。
2.2.自然宿主
对于在中国爆发的两种萨斯病毒,蝙蝠均被怀疑是自然宿主。据称,萨斯冠状病毒起源于云南省一个山洞的马蹄蝠 [22]。
2005年,在中国云南省一个山洞中的野生中国马蹄蝠(Rhinolophus sinicus)中采集到了萨斯样冠状病毒[22]。2013年,从蝙蝠粪便中培养的Vero E6细胞中分离出活的萨斯样冠状病毒毒株 [23]。分离出的病毒株与感染人类和果子狸的萨斯冠状病毒的基因组序列一致性超过95%。萨斯样冠状病毒拥有使用其S蛋白与血管紧张素转换酶2受体结合的入侵细胞的能力[24]。该研究结果揭示萨斯冠状病毒可能起源于中国的马蹄蝠,从蝙蝠中分离得到的萨斯样冠状病毒还可在没有任何中间宿主参与的情况下具备入侵人体细胞的潜力。在2015年至2017年之间,从中国浙江省舟山市采集的334只蝙蝠中,总共有26.65%被检出具有冠状病毒RNA依赖的RNA聚合酶(RdRp)。两种萨斯样冠状病毒(蝙蝠萨斯样冠状病毒ZC45和蝙蝠萨斯样冠状病毒ZXC21)的完整基因组分析表明,它们与人/果子狸的萨斯冠状病毒具有81%的核苷酸同一性。这些病毒可在乳鼠中传播并引起疾病,通过电子显微镜可在乳鼠的大脑中观察到病毒样颗粒[25]。
因此,在2018年之前,已有证据表明,在中国某些地区收集的蝙蝠携带能够直接感染人类的??冠状病毒。
最近的一项研究表明,萨斯冠状病毒-2与蝙蝠冠状病毒在整个基因组水平上具有96%的同源性。对七个保守的非结构蛋白的成对蛋白序列分析表明,该病毒属于萨斯冠状病毒物种[26]。在系统分类分析中,萨斯冠状病毒和萨斯冠状病毒-2不仅具有共同的祖先,而且氨基酸同一性为82.3%[27-29]。
2.3.中间宿主
病毒通常需要中间宿主,才能从蝙蝠传播给人类。例如,尼帕病毒的中间宿主是猪,而塻斯冠状病毒的中间宿主是骆驼[30,31]。在萨斯1爆发期间,果子狸最初被认为是萨斯冠状病毒的自然宿主[31]。后来,当蝙蝠被证实是萨斯冠状病毒的自然宿主后,果子狸才被重新定义为中间宿主。事实上,除了果子狸,研究人员还在广东海鲜市场上从家猫,赤狐,小稻田鼠,鹅,中国雪貂和野猪的标本中发现了萨斯冠状病毒。研究提示,萨斯冠状病毒应该是从云南马蹄蝠传播给果子狸,而携带该病毒的果子狸被运送到广东,最终导致了人感染萨斯冠状病毒和广东省萨斯的爆发[32]。
当前,已有一些动物被怀疑萨斯冠状病毒-2的中间宿主。一项研究表明,萨斯冠状病毒-2与蛇具有相同的密码子使用偏倚。因此,蛇可能是萨斯冠状病毒-2的中间宿主[33]。但是,英国格拉斯哥大学的病毒学家David Robertson表示:“没有任何证据可以支持蛇可以被这种病毒入侵。”同时,圣保罗大学的病毒学家Paulo EduardoBrandão也表示:“没有证据表明蛇可以被这种新型冠状病毒感染并作为宿主” [34]。对从马来西亚走私到中国的患病穿山甲的基因组序列研究发现,穿山甲携带冠状病毒,表明穿山甲可能是萨斯冠状病毒-2的中间宿主[35]。在华南广西和广东的反走私行动中查获的穿山甲也发现带有多株冠状病毒,与萨斯冠状病毒-2的基因组序列相似度为85.5–92.4%[36]。更有趣的是,另一项研究表明,从某未指明机构笼养的穿山甲中收集的冠状病毒与萨斯冠状病毒-2的基因组序列同一性超过99%[37]。不过,萨斯冠状病毒-2治疗专家组组长钟南山预测萨斯冠状病毒-2的中间宿主是竹鼠[38]。根据舟山的动物分布表明,这里不仅是携带蝙蝠萨斯样冠状病毒ZC45的蝙蝠的自然栖息地,还是眼镜蛇,竹鼠和穿山甲的自然栖息地[39-41]。
2.4. 终极宿主
野生生物中的病毒在获得感染人类的能力之前,通常会在其病毒基因组中积累一系列突变[42]。而发生这些的原因通常是由于人类对自然生态系统的入侵,例如,最初感染人类的艾滋病来自西非雨林中的黑猩猩就是一个例子[43,44]。
萨斯冠状病毒在传播给人类之前可能会具有物种屏障。然而,由于人类活动,病毒跨越了这种屏障。人们发现果子狸身上中发现了导致萨斯1爆发的萨斯冠状病毒[32]。而目前在野生蝙蝠[26],蛇[33]和穿山甲[35-37,45]中检测到在基因组序列上与萨斯冠状病毒-2相似的病毒。
因此,由于人类与野生生物的某些不恰当的相处模式,使人类暴露在这些不友好的病毒中,最终导致人类不幸成为萨斯冠状病毒的宿主(图2)。

图2. 萨斯冠状病毒-2向人类传播的潜在途径。
携带萨斯冠状病毒-2的蝙蝠被绿灯或红灯吸引,并定居在昆虫富集的区域。 萨斯冠状病毒-2可以直接传播给人类,也可以通过蝙蝠的唾液,尿液和粪便传播给中间宿主,例如竹鼠,蛇和穿山甲。最终中间宿主将萨斯冠状病毒-2传播给人类。
3. 萨斯2爆发场景假想
在确定了一些影响两种萨斯冠状病毒流行的自然因素和社会因素后,还有必要讨论这些因素的变化是否导致武汉地区萨斯2的独特爆发。 由于许多与萨斯2流行的混淆因素依然未知,因此我们在此只假设不同场景下武汉市萨斯2的爆发(图3)。
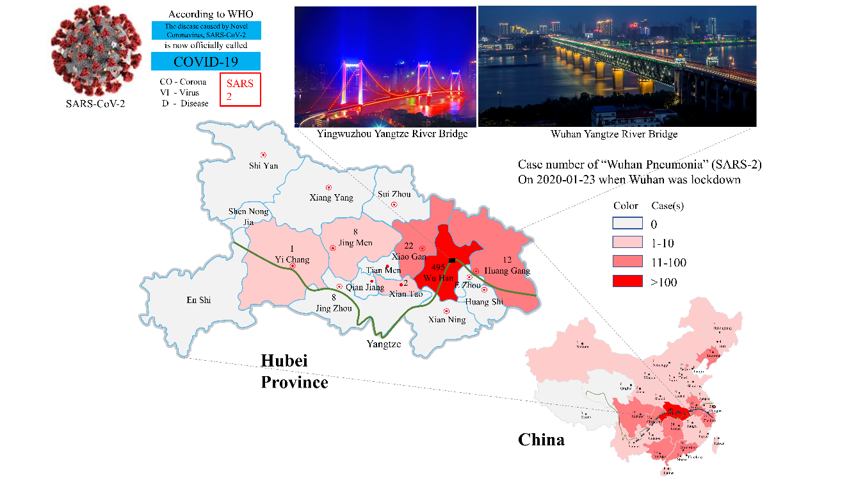
图3.武汉爆发萨斯2,并在中国各地蔓延,严重影响了湖北省的周边地区。
地图上显示的病例反映了武汉被封锁之日的流行情况。蝙蝠的已知和潜在迁徙路线分别在中国地图上以实线和虚线显示。在中国和湖北省的两个地图中,长江均以绿线显示。
3.1.单一爆发点和单一病毒来源
早先的猜测以及发表的文章中表达的主导观点都认为萨斯2爆发是从武汉的一个地点开始的,即华南海鲜市场[46]。但是,携带接近萨斯冠状病毒-2的病毒的蝙蝠存在于远离武汉的浙江舟山。舟山是浙江最大的竹鼠繁殖基地之一,而竹鼠被怀疑是萨斯冠状病毒-2的中间宿主之一[38,47]。
因此,如果病毒想要感染武汉的人群,这些携带病毒的蝙蝠和(或)竹鼠首先必须能够迁移或运送到武汉,并且还必须携带实际上已经实现了突变并可以感染人类的病毒。
蝙蝠具有超过1000公里的迁徙能力,并且倾向于飞往昆虫富集的区域[48]。由于贩卖各种动物,在野生动物市场区域经常会有大量昆虫出没。动物尸体也促成这些地区成为蝙蝠的栖息地。更为重要的是,蝙蝠在活动或迁移过程中会被人造绿灯所吸引,并倾向于聚集在绿灯区域周围[49]。
与这些自然特征相吻合的是,人们发现蝙蝠居住在长江大桥的附近,而长江大桥上有一排排绿灯,夜夜常明。值得一提的是,华南海鲜市场距离这座桥只有20分钟的路程。因此,聚集在长江大桥附近的蝙蝠可能已经释放了病毒,而这些病毒感染中间宿主可能已经有一段时间了。寒冷干燥的冬天帮助病毒在环境中生存,并最终找到了跨越物种屏障的方法,这种现象被称为“病毒震颤” [50]。事实上,人类在冬季变的更为脆弱,节假日期间人与野生动物的接触增加,从而使人类更容易感染上萨斯冠状病毒-2。
目前,尚无证据证明华南海鲜市场的竹鼠来源。因此,竹鼠感染萨斯冠状病毒-2的地点可能有两个。
第一个地点可能是舟山的蝙蝠栖息地。由于2018年华农兄弟促进了竹鼠育种,竹鼠育种数量和市场需求显着增加[51]。由于市场需求增加,新的竹鼠繁殖基地可能距离携带萨斯冠状病毒-2的蝙蝠自然栖息地不远。于是,与尼帕病毒类似,萨斯冠状病毒-2传播的模式是由于人类在蝙蝠的栖息地周围建立农场,使蝙蝠通过唾液,尿液和粪便将病毒传播给动物[30]。同时,由于浙江是竹鼠的自然栖息地,因此有些农场可能会直接引入已经感染萨斯冠状病毒-2的野生竹鼠。由于上述原因,携带萨斯冠状病毒-2的竹鼠被从感染的地方运送到病毒爆发地,其迁移方式与果子狸传播萨斯冠状病毒的方式相同[32]。
第二个地点是萨斯冠状病毒-2爆发地武汉,也是一些蝙蝠迁徙的终点。中国科学院武汉病毒研究所的石正丽研究小组曾在马蹄蝠的粪便中分离出了一种类似萨斯冠状病毒的活菌株[23]。这表明蝙蝠传播病毒的方式不仅通过直接接触,而且还通过粪便。因此,当携带萨斯冠状病毒-2病毒的蝙蝠在华南海鲜市场区域觅食时,可能会将病毒直接或间接地传递给中间宿主。
但是,要确认这种情况,有必要在武汉及其附近地区寻找到某些野生蝙蝠携带的冠状病毒与从各种萨斯2病人标本中分离出的冠状病毒相同。还需要找到一种机制,自然来源的萨斯冠状病毒-2如何在如此广泛的区域内迅速爆发。
3.2.多个爆发点和多个病毒源
流行病学调查显示,在最初诊断为冠状病毒-2感染的41例病人中,有13例与华南海鲜市场无关[45]。另一项对萨斯2的调查发现,华南海鲜市场上没有蝙蝠出售 [52]。
由于自然和人为因素,如此多的蝙蝠聚集在某个地方,因此蝙蝠传播病毒的范围可能比仅仅局限于一个野生动物交易场所(例如华南海鲜市场)要广得多。这些病毒可能已经在这个巨大的“孵化床”中生存了一段时间,并且在跳入最终人类宿主之前发生了一些变异。
对香港和广东的马蹄蝠研究表明,这两个地方的马蹄蝠携带的病毒是不同的。而且,发现一些马蹄蝠在交配和觅食活动后会同时携带两种病毒。这表明马蹄蝙蝠不仅具有迁移能力,而且具有促进病毒在同一栖息地内以及在不同栖息地之间传播的能力。此外,对蝙蝠在多个区域携带的病毒的整个基因组进行测序,发现不同菌株之间频繁重组。例如,在中国广西的SARSr-Rh-BatCoV Rp3和中国湖北的Rf1之间检测到果子狸的SARSr-CoV SZ3重组。因此,萨斯冠状病毒-2有可能由于蝙蝠的迁徙而从舟山传播到武汉。
事实证明,蝙蝠不仅被绿灯吸引,还会被红灯吸引[54]。沿着长江,还有多座巨大的桥梁,上面装饰着大量的红灯。因此,沿长江迁移的蝙蝠可能会被这些红灯所吸引,并重新安置在附近。由于这些人造灯光,使武汉可能成为大量蝙蝠的新栖息地。这些来自不同地域的蝙蝠可能携带不同的病毒株。这些病毒的单独进化和重组可能导致产生能够跨物种传播和最终感染人类的萨斯冠状病毒。
3.3. 多个爆发点和独特的病毒源
许多迹象表明,萨斯2的爆发实际上是从多个地点开始的,而不是最初报道的单个地点[27,52,53,55]。在评估武汉市,武汉市周边和武汉市以外的萨斯2的流行病学模式时,萨斯2的发生似乎具有不同的模式。尽管远程发生的萨斯2通常具有人与人之间的联系,并且可以追溯到单一的传染源,但是一些武汉市和周边地区的病例仍缺乏可靠的传染源。令人惊讶的是,大多数萨斯2患者都可以追溯到单个独特的萨斯冠状病毒-2病原体。这种单一独特的病毒源如何迅速感染如此大的地理区域中的如此多的人群?这个问题现在很难回答,但是将来必须得到解答。
4. 萨斯防治建议
4.1. 控制进行中的萨斯2的流行
尽管萨斯冠状病毒-2的起源和发生情况尚不清楚,但当前流行病的控制措施应集中在切断疾病传播途径,隔离患者(已确认和疑似),隔离易感人群以及保护高风险职业是减少和消除病毒传播风险的必要措施。同时,必须对病毒存在的区域进行充分消毒。具体而言,应对将要向公众开放的区域进行仔细检测,并及时清除那些被发现的病毒。应用现代通讯手段,及时传递有关流行病状况,治疗措施和自我防护措施等方面的可靠信息。实际上,利用细微高效的互联网控制,可以将 “公众观点”的监控转化为“流行情况”的有效监测,从而经济实用的应对各种大范围传染爆发。
4.2.未来潜在萨斯的预防策略
萨斯冠状病毒-2已进入人类社会,即使从人类社会中消除病毒也不意味着其在自然界中会被消除。萨斯冠状病毒-2感染的风险将持续很长时间。因此,必须采取足够谨慎的措施,以防范未来可能爆发的萨斯。可以通过建立一个综合的系统来进行预防,该系统应同时考虑前面讨论过的萨斯流行病学的自然和社会因素。例如,应该对自然界中的病毒状况进行定期监视,以检测病毒的变异/进化和丰度/定位。该信息可用作预警,并用于制备潜在的疫苗。政府应颁布法律和政策,加强对野生动物的保护,并禁止食用野生动物。应建立具有草根基础的透明的报告系统,并公开报告任何已确诊或怀疑的人类感染病例。疾病报告系统应与气象系统有机地结合,以便预测利于人类病毒感染的不利环境条件,并在紧急情况下进行大规模的准备工作。最后,在发展人类社会(包括为居住和运输建造大型建筑物)的时候,应仔细评估对野生生物的潜在生态影响以及破坏生态系统自然平衡的可能后果。
5。结论
这份小型综述评估了中国萨斯流行的常见流行病学模式,并确定寒冷干燥的冬天是导致萨斯病毒感染人类的??常见环境条件。因此,应将气象信息纳入对新萨斯潜在爆发的未来预测中。蝙蝠极有可能是萨斯冠状病毒的自然宿主,其它一些野生动物可能是潜在的中间宿主,因此保护自然生态系统和禁止野生动物消费是人类预防萨斯的要求。对萨斯暴发的不同场景的假设表明确定萨斯冠状病毒真正来源和建立更全面的抗病毒措施以抵抗任何类型的病毒入侵都是迫切需要的。
作者贡献:所有作者都对此稿做出了贡献。 Z.S. 设计、起草和编辑原始手稿。 K.T. 审查并编辑了原始手稿。 S.K. 编辑了原始手稿。 G.Z.H. 概念化并设计了手稿的框架。 S.V.L. 撰写了手稿的修订本,并将他许多独立的思想带入了修订后的手稿中。 所有作者均已阅读并同意该手稿的发行版本。
致谢:感谢原同济医科大学校友无私的帮助和上海交通大学医学院陶老师对前期稿件提出的建议。
资金资助:这项工作得到了国家自然科学基金的部分资助,资助号为 71964020。
利益冲突:作者声明没有利益冲突。
参考文献
- Andersen, K.G.; Rambaut, A.; Lipkin, W.L.; Holmes, E.C.; Garry, R.F. The Proximal Origin of SARS-CoV-2. ARTIC Network, 17 February 2020. Available online: http://virological.org/t/the-proximal-origin-of-sars-cov-2/398 (accessed on 18 February 2020).
- Human Coronavirus Types. Centers for Disease Control and Prevention, 15 February 2020. Available online: https://www.cdc.gov/coronavirus/types.html (accessed on 18 February 2020).
- Fehr, A.R.; Perlman, S. Coronaviruses: An overview of their replication and pathogenesis. Methods Mol. Biol. 2015, 1282, 1–23, doi:10.1007/978-1-4939-2438-7_1.
- Li, W.H.; Moore, M.J.; Vasilieva, N.; Sui, J.H.; Wong, S.K.; Berne, M.A.; Somasundaran, M.; Sullivan, J.L.; Luzuriaga, K.; Greenough, T.C., et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature 2003, 426, 450–454, doi:10.1038/nature02145.
- van Doremlen, N.; Miazgowicz, K.; Milne-Price, S.; Bushmaker, T.; Robertson, S.; Scott, D.; Kinne, J.; S. McLellan, J.; Zhu, J.; J. Munster, V. Host Species Restriction of Middle East Respiratory Syndrome Coronavirus through Its Receptor, Dipeptidyl Peptidase 4. J. Virol 2014, 88, 9220–9232, doi:10.1128/JVI.00676-14.
- Xu, R.H.; He, J.F.; Evans, M.R.; Peng, G.W.; Field, H.E.; Yu, D.W.; Lee, C.K.; Luo, H.M.; Lin, W.S.; Lin, P., et al. Epidemiologic clues to SARS origin in China. Emerg. Infect. Dis. 2004, 10, 1030–1037, doi:10.3201/eid1006.030852.
- Lu, H.; Stratton, C.W.; Tang, Y.W. Outbreak of Pneumonia of Unknown Etiology in Wuhan China: The Mystery and the Miracle. J. Med. Virol. 2020, 92, 401–402, doi:10.1002/jmv.25678.
- NBSC. National Bureau of Statistics PRC: China Statistical Yearbook 2018 (Chinese-English Edition); China Statistics Press: Beijing, China, 2018.
- NBSC. National Bureau of Statistics PRC: China Statistical Yearbook 2019 (Chinese-English Edition); China Statistics Press: Beijing, China, 2019.
- Shi, N.N.; Liu, J.Y.; Kuang, Y.L.; Zhou, Y.Y.; Liao, Q.; Liu, Z.F. Characteristics and Influences of Precipitation Tendency in Foshan under Environmental Varia. J. Water Resour. 2014, 03, 41-49, doi:10.12677/jwrr.2014.31007.
- Drought stress in 2002. China Weather Network. 06 May 2010. Available online: http://www.weather.com.cn/drought/ghsj/2002/05/443027.shtml (accessed on 18 February 2020).
- Ding, Y.T. Heavy drought in the middle and lower reaches of Yangtze River. People Net, 07 November 2019. Available online: http://paper.people.com.cn/rmrb/html/2019-11/07/nw.D110000renmrb_20191107_2-17.htm (accessed on 18 February 2020).
- The average rainfall in Wuhan in December was 26 millimeters, and there were only scattered light rain on the 3rd. Wuhan Weather News. Available online: https://weather.mipang.com/wuhan/news-1549253.html# (accessed on 18 February 2020).
- Schneider, U.; Becker, A.; Finger, P.; Meyer-Christoffer, A.; Ziese, M.; Rudolf, B. GPCC’s new land surface precipitation climatology based on quality-controlled in situ data and its role in quantifying the global water cycle. Theor. Appl. Climatol. 2014, 115, 15–40, doi:10.1007/s00704-013-0860-x.
- Casanova, L.M.; Jeon, S.; Rutala, W.A.; Weber, D.J.; Sobsey, M.D. Effects of air temperature and relative humidity on coronavirus survival on surfaces. Appl. Environ. Microbiol. 2010, 76, 2712–2717, doi:10.1128/AEM.02291-09.
- Chan, K.H.; Peiris, J.S.; Lam, S.Y.; Poon, L.L.; Yuen, K.Y.; Seto, W.H. The Effects of Temperature and Relative Humidity on the Viability of the SARS Coronavirus. Adv. Virol. 2011, 2011, 734690, doi:10.1155/2011/734690.
- Jaakkola, K.; Saukkoriipi, A.; Jokelainen, J.; Juvonen, R.; Kauppila, J.; Vainio, O.; Ziegler, T.; Ronkko, E.; Jaakkola, J.J.; Ikaheimo, T.M.; et al. Decline in temperature and humidity increases the occurrence of influenza in cold climate. Environ. Health 2014, 13, 22, doi:10.1186/1476-069X-13-22.
- Kudo, E.; Song, E.; Yockey, L.J.; Rakib, T.; Wong, P.W.; Homer, R.J.; Iwasaki, A. Low ambient humidity impairs barrier function and innate resistance against influenza infection. Proc. Natl. Acad. Sci. U.S.A. 2019, 116, 10905–10910, doi:10.1073/pnas.1902840116.
- Relative humidity. Wikipedia. Available online: https://en.wikipedia.org/wiki/Relative_humidity (accessed on 18 February 2020).
- Zaki, A.M.; van Boheemen, S.; Bestebroer, T.M.; Osterhaus, A.D.; Fouchier, R.A. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. New Engl. J. Med. 2012, 367, 1814–1820, doi:10.1056/NEJMoa1211721.
- Monthly weather forecast and climate Jeddah, Saudi Arabia. Weather Atlas. Available online: https://www.weather-atlas.com/en/saudi-arabia/jeddah-climate (accessed on 15 February 2020).
- Hu, B.; Zeng, L.P.; Yang, X.L.; Ge, X.Y.; Zhang, W.; Li, B.; Xie, J.Z.; Shen, X.R.; Zhang, Y.Z.; Wang, N., et al. Discovery of a rich gene pool of bat SARS-related coronaviruses provides new insights into the origin of SARS coronavirus. PLoS Pathog. 2017, 13, e1006698, doi:10.1371/journal.ppat.1006698.
- Ge, X.Y.; Li, J.L.; Yang, X.L.; Chmura, A.A.; Zhu, G.; Epstein, J.H.; Mazet, J.K.; Hu, B.; Zhang, W.; Peng, C.; et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor. Nature 2013, 503, 535–538, doi:10.1038/nature12711.
- Yang, X. L.; Hu, B.; Wang, B.; Wang, M.N.; Zhang, Q.; Zhang, W.; Wu, L.J.; Ge, X.Y.; Zhang, Y.Z.; Daszak, P., et al. Isolation and characterization of a novel bat coronavirus closely related to the direct progenitor of severe acute respiratory syndrome coronavirus. J. Virol. 2015, 90, 3253–3256, doi:10.1128/JVI.02582-15.
- Hu, D.; Zhu, C.Q.; Ai, L.L.; He, T.; Wang, Y.; Ye, F.Q.; Yang, L.; Ding, C.X.; Zhu, X.H.; Lv, R.C., et al. Genomic characterization and infectivity of a novel SARS-like coronavirus in Chinese bats. Emerg. Microbes Infect. 2018, 7, 1–10, doi:10.1038/s41426-018-0155-5.
- Zhou, P.; Yang, X.L.; Wang, X.G.; Hu, B.; Zhang, L.; Zhang, W.; Si, H.R.; Zhu, Y.; Li, B.; Huang, C.L., et al. Discovery of a novel coronavirus associated with the recent pneumonia outbreak in humans and its potential bat origin. Biorxiv 2020, doi:10.1101/2020.01.22.914952.
- Lu, R.; Zhao, X.; Li, J.; Niu, P.; Yang, B.; Wu, H.; Wang, W.; Song, H.; Huang, B.; Zhu, N.; et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: Implications for virus origins and receptor binding. Lancet 2020, 395, 565–574, doi:10.1016/S0140-6736(20)30251-8.
- Wu, F.; Zhao, S.; Yu, B.; Chen, Y.-M.; Wang, W.; Song, Z.-G.; Hu, Y.; Tao, Z.-W.; Tian, J.-H.; Pei, Y.-Y.; et al. A new coronavirus associated with human respiratory disease in China. Nature 2020, doi:10.1038/s41586-020-2008-3.
- Chan, J.F.-W.; Yuan, S.; Kok, K.-H.; To, K.K.-W.; Chu, H.; Yang, J.; Xing, F.; Liu, J.; Yip, C.C.-Y.; Poon, R.W.-S.; et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: A study of a family cluster. Lancet 2020, 395, 514–523, doi:10.1016/S0140-6736(20)30154-9.
- Kulkarni, D.D.; Tosh, C.; Venkatesh, G.; Senthil Kumar, D. Nipah virus infection: Current scenario. Indian. J. Virol. 2013, 24, 398–408, doi:10.1007/s13337-013-0171-y.
- Widagdo, W.; Sooksawasdi Na Ayudhya, S.; Hundie, G.B.; Haagmans, B.L. Host Determinants of MERS-CoV Transmission and Pathogenesis. Viruses 2019, 11, 280, doi:10.3390/v11030280.
- Chan, P.K.; Chan, M.C. Tracing the SARS-coronavirus. J. Thorac. Dis. 2013, 5 (Suppl 2), S118–S121, doi:10.3978/j.issn.2072-1439.2013.06.19.
- Ji, W.; Wang, W.; Zhao, X.; Zai, J.; Li, X. Homologous recombination within the spike glycoprotein of the newly identified coronavirus may boost cross-species transmission from snake to human. J. Med. Virol. Accepted, 2020, doi:10.1002/jmv.25682.
- Callaway, E.; Cyranoski, D. “Why snakes probably aren’t spreading the new China virus,” Nature 2020, doi: 10.1038/d41586-020-00180-8.
- Liu, P.; Chen, W.; Chen, J.-P. Viral Metagenomics Revealed Sendai Virus and Coronavirus Infection of Malayan Pangolins (Manis javanica). Viruses 2019, 11, 979.
- Lam, T. T.-Y.; Shum, M.H.-H.; Zhu, H.C.; Tong, Y.G.; Ni, X.B.; Liao, Y.S.; Wei, W.; Cheung, W.Y.-M.; Li, W.J.; Li, L.F., et al. Identification of 2019-nCoV related coronaviruses in Malayan pangolins in southern China. Biorxiv 2020, doi:10.1101/2020.02.13.945485.
- Sequence similarity between pangolin and infected human strain is 99%. sohu. Available online: https://www.sohu.com/a/371763329_313745 (accessed on 18 February 2020).
- Zhong Nanshan: The new coronavirus is likely to come from game products such as bamboo rats and tadpoles. Netease News, 20 January 2020. Available online: https://news.163.com/20/0120/22/F3C9KSI50001899O.html (accessed on 18 February 2020).
- Chinese cobra. Wikipedia. Available online: https://en.wikipedia.org/wiki/Chinese_cobra (accessed on 18 February 2020).
- Zhang, X.R.; Pan, J.; Yue, C.L.; Li, H.P.; Wang, J. Analysis of the Mammal Diversity and Fauna in Zhejiang Province. Chinese J. Wildl. 2019, 40, 37–47, doi:10.19711/j.cnki.issn2310-1490.2019.04.006.
- Zhu, X.; Cao, W.B.; Wang, J. Mammalian fauna and distribution of Putuoshan Island in Zhoushan. J. Zhejiang A F Univ. 2010, 27, 110–115, doi:10.11833/j.issn.2095-0756.2010.01.01.
- Letko, M.; Miazgowicz, K.; McMinn, R.; Seifert, S.N.; Sola, I.; Enjuanes, L.; Carmody, A.; van Doremalen, N.; Munster, V. Adaptive Evolution of MERS-CoV to Species Variation in DPP4. Cell Rep. 2018, 24, 1730–1737, doi:10.1016/j.celrep.2018.07.045.
- Hilary F. F. Vanishing Borders: Protecting the Planet in the Age of Globalization; W. W. Norton & Company: New York, NY, USA, 2000; Chapters 1 to 6.
- Sharp, P.M.; Hahn, B.H. Origins of HIV and the AIDS pandemic. Cold Spring Harb. Perspect. Med. 2011, 1, a006841, doi:10.1101/cshperspect.a006841.
- Huang, C.; Wang, Y.; Li, X.; Ren, L.; Zhao, J.; Hu, Y.; Zhang, L.; Fan, G.; Xu, J.; Gu, X.; et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020, 395, 497–506, doi:10.1016/S0140-6736(20)30183-5.
- Tan, W.J.; Zhao, X.; Ma, X.J.; Wang, W.L.; Niu, P.H.; Xu, W.B.; Gao, G.F.; Wu, G.Z. A Novel Coronavirus Genome Identified in a Cluster of Pneumonia Cases—Wuhan, China 2019−2020. China CDC weekly, January 21 2020. Available online: http://weekly.chinacdc.cn/en/article/id/a3907201-f64f-4154-a19e-4253b453d10c. (Accessed on 18 February 2020).
- The largest bamboo rat Chinese silver star bamboo rat breeding base in Zhoushan. Shanghang.net, 03 July 2018. Available online: http://www.shanghang.net/q-2382.html (accessed on 18 February 2020).
- Dechmann, D.K.N.; Wikelski, M.; Ellis-Soto, D.; Safi, K.; O’Mara, M.T. Determinants of spring migration departure decision in a bat. Biol. Lett. 2017, 13, doi:10.1098/rsbl.2017.0395.
- Voigt, C.C.; Roeleke, M.; Marggraf, L.; Petersons, G.; Voigt-Heucke, S.L. Migratory bats respond to artificial green light with positive phototaxis. PLoS One 2017, 12, e0177748, doi:10.1371/journal.pone.0177748.
- Deka, M.A.; Morshed, N. Mapping Disease Transmission Risk of Nipah Virus in South and Southeast Asia. Trop. Med. Infect. Dis. 2018, 3, doi:10.3390/tropicalmed3020057.
- Xi, G.H. Adventures of Huanong Brothers: Shooting bamboo rat videos became popular, fans exceeded 5 million and annual income exceeded 300,000. Tencent, 05 February 2020. Available online: https://new.qq.com/omn/20190205/20190205A0G1Q7.html (accessed on 18 February 2020).
- 1st death in US from coronavirus: Live updates on COVID-19. Live Science. 1 March 2020. Available online: https://www.livescience.com/new-china-coronavirus-faq.html (accessed on 1 March 2020).
- Lau, S.K.P.; Li, K.S.M.; Huang, Y.; Shek, C.-T.; Tse, H.; Wang, M.; Choi, G.K.Y.; Xu, H.F.; Lam, C.S.F. Guo, R.T., et al. Ecoepidemiology and complete genome comparison of different strains of severe acute respiratory syndrome-related Rhinolophus bat coronavirus in China reveal bats as a reservoir for acute, self-limiting infection that allows recombination events. J. Virol. 2010, 84, 2808–2819, doi:10.1128/jvi.02219-09.
- Voigt, C.C.; Rehnig, K.; Lindecke, O.; Pētersons, G. Migratory bats are attracted by red light but not by warm-white light: Implications for the protection of nocturnal migrants. Ecol. Evol. 2018, 8, 9353–9361, doi:10.1002/ece3.4400.
- Xiong, C.L.; Jiang, L.F.; Chen, Y.; Jiang, Q.W. Evolution and variation of 2019-novel coronavirus. Biorxiv 2020, doi:10.1101/2020.01.30.926477.




