这两天关于心脏病谈得火热, 特别介绍自然杂志八月份的一篇论文(文献1), 该论文阐述了一个重要的心肌细胞膜蛋白的结构功能, 为进一步医学应用打下基础. 本文介绍该论文的成果,并涉及我们熟悉的两个人物和两个诺贝尔奖.
一, 心肌细胞的钙离子自嗨
心脏有20亿个心肌细胞, 这些细胞协调作战, 保证正常心跳, 为人体提供血液, 氧气与养料. 心肌的协调作战很复杂. Khan Adademy的这个视频介绍了心肌的运作机理. 这里只简短介绍与论文最有关的知识.
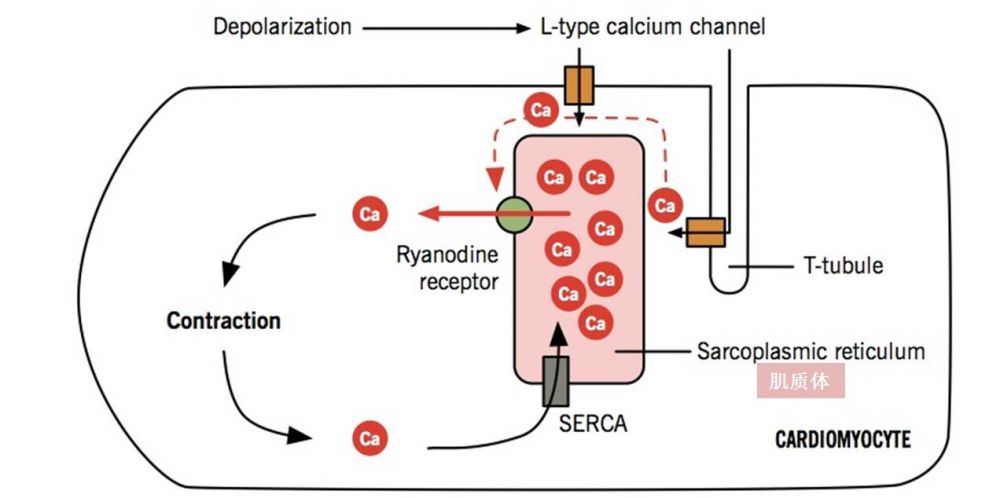
心肌细胞工作需要钙离子在瞬间增加千倍, 这不是能简单地从细胞外获取的. 于是自然界就发明了自嗨的这个机制, 学名是 : Calcium Induced Calcium Release. 大致过程是: 少量钙离子因受刺激进入细胞, 引发细胞内的肌质体(Sarcoplamic Reticulum) 从细胞内大量释放钙离子。 这是钙离子自导自演的释放,所以叫自嗨。 自嗨是通过受到外来钙离子的Ryanodine receptor这个离子通道完成(同学们,是否似曾相识呢?)。 Ryanodine receptor大开闸门, 大量释钙,使心肌细胞内的钙浓度瞬间增加千倍以上。
然而钙离子不能总是自嗨,否则心肌就会永远处于收缩紧张的状态。为了有张有弛, 肌质体必须回收并防止钙离子的继续流失。 一种叫钙调蛋白 (Calmodulin)在这个过程中,起到了重要作用。
 二 论文成果。 二 论文成果。
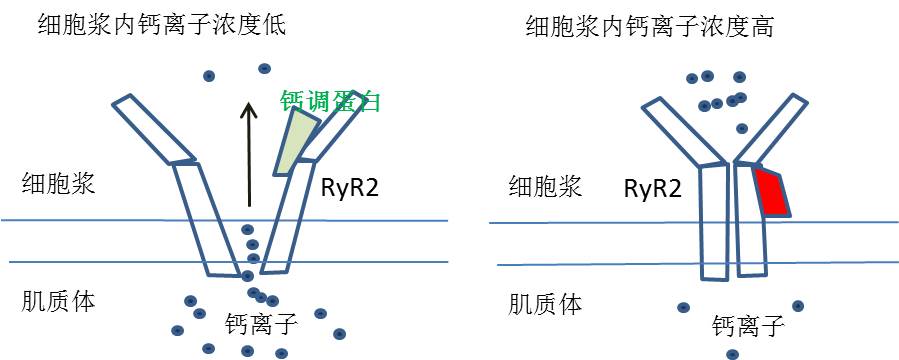
该论文用冷冻电镜(Cryo-EM) 展示了钙调蛋白(CaM)与Ryanodine receptor(RyR2)在八个条件下的结构, 并阐述了钙调蛋白(CaM)对Ryanodine receptor(RyR2)的调节作用。 这两个蛋白的相互作用的失常,会导致心力衰竭(Heart Failure).
如下图所示:当钙离子外来户来到细胞内刺激了RyR2的打开通道, 肌质体内钙大量离子流入细胞浆内。这时钙调蛋白不起作用(注:这与骨骼肌细胞不同)。 当细胞浆内钙离子浓度达到一定高度时, 钙调蛋白变形,并改变了与钙离子通道结合的位置,促使钙离子通道变形,关闭了通道。 论文在分子水平上,详细地描述了蛋白的结构变化,非常有趣,我在此不再详述。 有兴趣的读者请读论文,会给你的感恩节带来一种不同的快乐。
三 不要搞混了老花镜。
不知读者是否猜到,该论文是小颜同学团队做出的成果。 实际上小颜同学普林斯顿网站上描述的研究方向正是用冷冻电镜。也就是说小颜同学在x射线晶体衍射成功之后,早已步入了新领域。 从网上搜来的未发表的论文看, 小颜团队不但已掌握了冷冻电镜技术,并提出了改进方案(文献2)。
请注意不要把冷冻电镜与庄小威同学的荧光显微镜搞混。 冷冻电镜是研究分子结构的工具, 该技术与2017年获得诺贝尔化学奖。荧光显微镜是用来直接观测分子在细胞内的位置与运动。 该技术于2014年获得诺贝尔化学奖。 两项技术的目的与手段是不同的。
四, 文献。
1。Deshun Gong, …, Nieng Yan Nature 2019 Vol 572, pp347. Modulation of cardiac ryanodine receptor 2 by calmodulin
2。Yimo Han, Xiao Fan, Haozhe Wang, Fang Zhao, Christopher G. Tully, Jing Kong, Nan Yao, Nieng Yan, High Yield Monolayer Graphene Grids for Near-Atomic Resolution Cryo-Electron Microscopy
|